Le droit d’essayer
De nombreux traitements en phase de développement pourraient soulager ou, peut-être, sauver des vies. Mais avant que le produit soit approuvé et mis sur le marché, dix années sont nécessaires. Un délai bien trop long pour les patients en phase terminale ! Aux États-Unis comme en Europe, il existe cependant plusieurs alternatives permettant l’accès aux traitements expérimentaux. Revue des possibilités offertes.
Premier recours pour accéder à un médicament expérimental, participer aux essais cliniques1. Des études contrôlées par les autorités de régulation des médicaments comme la FDA (Food and Drug Administration) ou l’EMA (European Medicines Agency). L’objectif est d’évaluer la sécurité du produit, son efficacité, la tolérance de l’organisme au traitement, puis de les comparer avec le médicament utilisé habituellement. Mais choisir de participer à un essai clinique n’est pas une garantie d’accéder au produit en développement. Seul un nombre restreint de patients voit leur participation validée et les malades ont une grande chance de recevoir un placébo2.
Autre possibilité, les programmes d’accès compassionnels. Mis en place depuis plus de 20 ans par la FDA et au début des années 2000 en Europe, ils permettent aux malades n’ayant pas accès aux essais cliniques de demander auprès des agences de santé l’accès à des traitements expérimentaux. Les autorisations sont cependant accordées sous certaines conditions comme démontrer qu’il n’existe pas de traitement satisfaisant et comparable, et que le laboratoire pharmaceutique soumette un protocole clinique compatible avec les règlementations. Depuis 2010, plus de 90 % des demandes d’accès aux programmes compassionnels ont été validés aux États-Unis.
Une nouvelle alternative américaine, la loi « Right To Try »
En mai 2014, le Colorado devient le premier état à entériner le projet de loi « Right To Try » (Droit d’essayer). Largement adoptée dans de nombreux états3, la loi contourne l’autorité de la FDA et permet de s’affranchir des formalités administratives. Elle donne aux patients atteints de maladies incurables le droit de demander directement aux laboratoires l’accès aux traitements en développement. Ces derniers doivent toutefois avoir passé avec succès la phase I des essais cliniques.
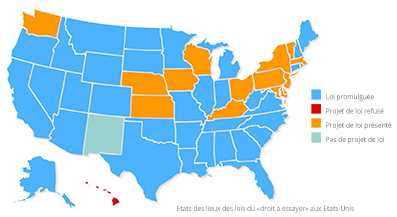 Malgré sa grande popularité auprès des citoyens et des législateurs, la loi soulève de nombreuses critiques dans le monde médical. Ses détracteurs lui reprochent par exemple de n’avoir terminé qu’une des trois phases des essais cliniques et ne pas avoir de données de sécurité sur les personnes très malades. D’autres la jugent contraire à l’éthique notamment sur le degré de responsabilité du laboratoire et du médecin, ou en créant des inégalités4. De plus, les patients seraient moins enclins à participer aux essais cliniques pourtant indispensables pour faire une demande d’AMM (Autorisation de Mise sur le Marché). D’un point de vue fédéral, la loi est jugée inconstitutionnelle par ses opposants. Elle a été néanmoins présentée au Sénat américain au printemps dernier. Nul doute son examen suscite de nombreux débats.
Malgré sa grande popularité auprès des citoyens et des législateurs, la loi soulève de nombreuses critiques dans le monde médical. Ses détracteurs lui reprochent par exemple de n’avoir terminé qu’une des trois phases des essais cliniques et ne pas avoir de données de sécurité sur les personnes très malades. D’autres la jugent contraire à l’éthique notamment sur le degré de responsabilité du laboratoire et du médecin, ou en créant des inégalités4. De plus, les patients seraient moins enclins à participer aux essais cliniques pourtant indispensables pour faire une demande d’AMM (Autorisation de Mise sur le Marché). D’un point de vue fédéral, la loi est jugée inconstitutionnelle par ses opposants. Elle a été néanmoins présentée au Sénat américain au printemps dernier. Nul doute son examen suscite de nombreux débats.
Sylvie Ponlot
1 – Flexmag 6, Médicament injectable, le parcours du combattant
2 – Préparation dépourvue de principe actif que l’on utilise pour son effet psychologique. Effet placébo.
3 – En septembre 2016, 32 États américains adopté la loi, 17 l’ont présentés. Seul le Nouveau Mexique ne l’a pas soumise au vote. Après avoir opposé un véto en 2015, le gouverneur de Californie, Jerry Brown, doit réexaminer prochainement le projet de loi.
4 – Les coûts prohibitifs non remboursés par les assurances de maladies privées. Dans certains états, les patients risqueraient de perdre leurs soins palliatifs ou leurs soins à domicile.



















